湖北省医疗器械不良事件监测年度报告 (2022年)
| 索 引 号 | MB1529176/2023-11610 | 发文日期 | 2023-05-15 |
|---|---|---|---|
| 发布机构 | 湖北省药品监督管理局 | 文 号 | 无 |
| 分 类 | 食品药品监管 | 效力状态 | 有效 |
为全面反映2022年湖北省医疗器械不良事件监测情况,提高公众安全用械水平,湖北省药品监督管理局组织湖北省药品(医疗器械)不良反应监测中心(以下简称湖北中心)编撰了《湖北省医疗器械不良事件监测年度报告(2022年)》。
一、医疗器械不良事件报告概况
2022年,全省医疗器械不良事件监测工作呈现良好发展态势,医疗器械不良事件报告数量较去年稳步增长。
(一)报告数量情况
2022年,湖北中心通过国家医疗器械不良事件监测信息系统共收到医疗器械不良事件报告36269份,其中省内报告25725份,与2021年相比上升了9.93%。
2012年至2022年,湖北省省内医疗器械不良事件报告数量总体呈逐年上升趋势(图1-1)。
 图1-1 2012-2022年全省上报医疗器械不良事件报告数量
图1-1 2012-2022年全省上报医疗器械不良事件报告数量
(二)每百万人口平均报告数量情况
2022年,湖北省每百万人口平均医疗器械不良事件报告数为445.4份,与2021年相比上升了12.83%。
(三)严重伤害及死亡不良事件报告情况
2022年,全省上报严重伤害及死亡医疗器械不良事件报告1063份,报告数量较2021年下降了2.66%(图1-2)。严重伤害及死亡报告占比4.13%,较2021年下降11.45%。
图1-2 2022年全省上报严重伤害及死亡事件报告情况
(四)注册基层用户数量情况
截止2022年12月31日,全省医疗器械不良事件监测在线注册基层用户11899家。其中,医疗器械注册人备案人1013家,占用户总数的8.51%;经营企业7101家,占用户总数的59.68%;使用单位(医疗机构)3785家,占用户总数的31.81%(图1-3)。
图1-3 2022年全省医疗器械不良事件监测系统注册基层用户情况
(五)小结与分析
2022年,全省上报报告25725份,每百万人口报告数445.4份,较2021年上升了12.83%;严重伤害及死亡报告比例仅为4.13%,较2021年下降了2.66%,提示报告可利用性有所下降,全省各市州监测机构需注重报告上报水平和信息可利用性。
2022年,在全省监测机构的共同努力下,全省基层用户注册数量较上年增长6.61%,各类型基层用户注册数量均有所提升。其中,注册人备案人注册数量增长11.71%,经营企业注册数量增长5.62%,使用单位注册数量增长7.19%。
二、医疗器械不良事件报告统计分析
(一)按报告来源统计分析
2022年,全省上报的医疗器械不良事件报告中,使用单位(医疗机构)的报告有22321份,占报告总数的86.77%,为报告的主体;经营企业报告3050份,占报告总数的11.86%;注册人备案人报告353份,占报告总数的1.37%,监测机构代报1份,占比不足0.01%(图2-1)。
图2-1 2022年全省医疗器械不良事件报告来源情况
(二)按不良事件伤害程度统计分析
2022年,全省上报的医疗器械不良事件报告中,伤害程度为严重伤害的报告1062份,占比4.13%;死亡的报告1份,占比小于0.01%;其他报告24662份,占比95.87%(图2-2)。与2021年相比,严重伤害及死亡报告数量下降了2.66%,占比仅为4.13%。
图2-2 2022年全省医疗器械不良事件伤害程度情况
(三)按医疗器械管理类别统计分析
2022年,全省上报的医疗器械不良事件报告中,涉及III类医疗器械的报告8466份,占报告总数32.91%;涉及II类医疗器械的报告12294份,占报告总数47.79%;涉及I类医疗器械的报告2135份,占报告总数8.30%;医疗器械类别不详的报告2830份,占报告总数11.00%。(图2-3)。
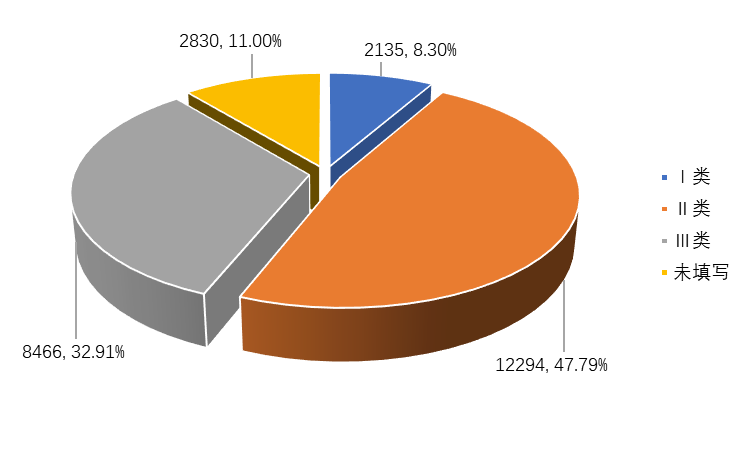
图2-3 2022年全省医疗器械不良事件涉及医疗器械管理类别情况
(四)按医疗器械分类目录统计分析
按现行《医疗器械分类目录》一级分类排序,报告数量排名前五位的分别为140000_注输、护理和防护器械,070000_医用诊察和监护器械,090000_物理治疗器械,080000_呼吸、麻醉和急救器械和220000_临床检验器械(表2-1)。
表2-1 按分类目录一级分类排名前十位
排名 | 产品分类 | 报告数 | 百分比(%) |
1 | 140000_注输、护理和防护器械 | 10202 | 45.34 |
2 | 070000_医用诊察和监护器械 | 2639 | 11.73 |
3 | 090000_物理治疗器械 | 2337 | 10.39 |
4 | 080000_呼吸、麻醉和急救器械 | 1019 | 4.53 |
5 | 220000_临床检验器械 | 992 | 4.41 |
6 | 180000_妇产科、辅助生殖和避孕器械 | 938 | 4.17 |
7 | 060000_医用成像器械 | 807 | 3.59 |
8 | 100000_输血、透析和体外循环器械 | 734 | 3.26 |
9 | 020000_无源手术器械 | 458 | 2.04 |
10 | 170000_口腔科器械 | 444 | 1.97 |
(五)按涉及使用场所统计分析
产品使用场所为医疗机构的报告22303份,占86.70%;使用场所为家庭的报告2916份,占11.34%;使用场所为其他的报告506份,占1.97%(图2-4)。医疗机构是医疗器械不良事件发生及报告的主要场所。
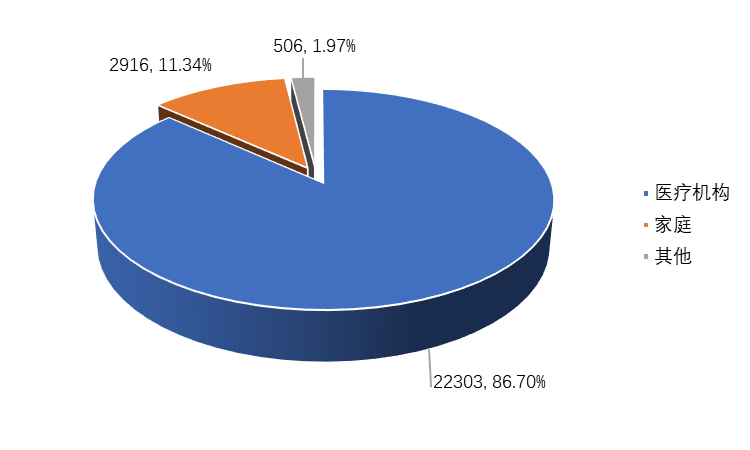
图2-4 2022年全省医疗器械不良事件涉及使用场所情况
(六)小结与分析
2022年,全省上报的医疗器械不良事件报告,来自使用单位(医疗机构)报告占比86.77%,使用单位(医疗机构)是医疗器械不良事件报告的主要来源,来自注册人备案人报告占比1.37%,报告偏少,提示需进一步压实注册人备案人主体责任,主动收集报告;II类、III类医疗器械的报告占比80.70%,为构成主体,提示II类、III类医疗器械风险需重点关注。
三、2022年全省医疗器械不良事件监测评价重点工作
(一)新冠疫情防控用医疗器械不良事件监测
2022年,持续加强疫情防控医疗器械不良事件监测评价工作,密切关注新冠病毒检测试剂、医用口罩、医用防护服、红外体温计、呼吸机等疫情防控医疗器械的不良事件,督促企业落实不良事件监测主体责任,防范化解产品风险。
(二)医疗器械不良事件风险评价
通过日常监测,根据产品的聚集性信号或严重程度,提取和确认产品风险。2022年以季度汇总的方式共向国家中心提交4个风险信号。
(三)“十四五”重点监测工作
根据国家局综合司《关于开展“十四五”期间医疗器械不良事件重点监测工作的通知》(药监综械管〔2021〕99号)文件精神,我省承担高电位治疗仪重点监测工作。2022年,湖北中心通过多次问卷调研、电话沟通等方式,对全国高电位治疗设备注册人开展调研,收集产品相关资料,了解该品种特点,生产、销售等情况。
(四)医疗器械注册人备案人检查工作
按照国家药品监督管理局医疗器械监督管理司《关于进一步做好医疗器械不良事件监测专项检查工作的函》《关于开展2022年医疗器械不良事件监测专项检查的函》要求,湖北省局高度重视,印发《关于进一步加强医疗器械不良事件监测专项检查工作的通知》,对全省医疗器械不良事件专项检查工作进行部署。组织省局医疗器械化妆品监管处、武汉分局、省药品(医疗器械)不良反应监测中心成立不良事件专项检查小组,于2022年7月分别对省内2家企业开展专项检查,并督促企业对发现的问题和潜在风险点进行整改,两家企业均按时提交整改报告。
(五)医疗器械不良事件监测工作宣传培训
2022年省药品(医疗器械)不良反应监测中心采用线上直播形式举办了湖北省药物警戒培训班和医疗器械不良事件监测培训班,共计1500余人参加培训。
湖北中心在黄鹤楼街道彭刘杨路社区开展2022年医疗器械安全宣传周 “安全用械进社区”活动。围绕“安全用械 共治共享”的主题,结合党员干部下沉社区、“下基层察民情解民忧暖民心”实践活动,联合武汉璟泓科技股份有限公司和湖北益健堂科技股份有限公司,现场受理、解答、讲解居民群众反映的医疗器械使用和安全问题。
四、有关情况说明
(一)与大多数国家一样,我国医疗器械不良事件报告通过自发报告系统收集并录入到数据库中,即当怀疑某种事件可能与医疗器械有关时,就可以上报。受报告者主观意识、经验水平、认知程度、甚至所持立场等影响,医疗器械不良事件的报告可能存在片面性和局限性,如伤害程度判读不准确、报告填写不规范、信息不完善等,甚至将与医疗器械无关的事件也按照不良事件上报,因此统计结果可能与实际发生的医疗器械不良事件情况存在偏差。
(二)不同医疗器械的不良事件报告数量受使用数量、风险程度、报告意识等诸多因素影响,因此报告数量的多少不直接代表医疗器械不良事件发生率的高低或者风险严重程度。
(三)上述统计数据来源于国家医疗器械不良事件监测信息系统中2022年1月1日至2022年12月31日湖北省收集的医疗器械不良事件数据。
小贴士
1.医疗器械:是指直接或者间接用于人体的仪器、设备、器具、体外诊断试剂及校准物、材料以及其他类似或者相关的物品,包括所需要的计算机软件;其效用主要通过物理等方式获得,不是通过药理学、免疫学或者代谢的方式获得,或者虽然有这些方式参与但是只起辅助作用;其目的是:
(1)疾病的诊断、预防、监护、治疗或者缓解;
(2)损伤的诊断、监护、治疗、缓解或者功能补偿;
(3)生理结构或者生理过程的检验、替代、调节或者支持;
(4)生命的支持或者维持;
(5)妊娠控制;
(6)通过对来自人体的样本进行检查,为医疗或者诊断目的提供信息。
2.医疗器械不良事件监测:是指对医疗器械不良事件的收集、报告、调查、分析、评价和控制的过程。
3.医疗器械不良事件:是指已上市的医疗器械,在正常使用情况下发生的、导致或者可能导致人体伤害的各种有害事件。
4.死亡医疗器械不良事件报告:指患者最终结果为死亡的医疗器械不良事件报告。不表示患者的死亡与使用医疗器械有明确的关联性。
5.医疗器械不良事件报告原则:报告医疗器械不良事件应当遵循可疑即报的原则,即怀疑某事件为医疗器械不良事件时,均可以作为医疗器械不良事件进行报告。报告内容应当真实、完整、准确。
导致或者可能导致严重伤害或者死亡的医疗器械不良事件应当报告;创新医疗器械在首个注册周期内,应当报告该产品的所有医疗器械不良事件。
6.国家医疗器械不良事件监测信息系统注册要求:注册人、经营企业和二级以上医疗机构应当注册为国家医疗器械不良事件监测信息系统用户,主动维护其用户信息,报告医疗器械不良事件。注册人应当持续跟踪和处理监测信息;产品注册信息发生变化的,应当在系统中立即更新。鼓励其他使用单位注册为国家医疗器械不良事件监测信息系统用户,报告医疗器械不良事件相关信息。
附件:

 鄂公网安备42010602003442
鄂公网安备42010602003442 网站地图
网站地图